IGF-1 faq
IGF-1 również znany jako somatomedyna – C to polipeptyd hormonu, o bardzo podobnych rozmiarach jak insulina. Jest produkowany w przeważającym stopniu w wątrobie w reakcji z hormonem wzrostu uwalniając go od gruczołów przysadki mózgowej.
Wiele z pośród czynników promujących efekty hormon wzrostu są z powodu możliwości uwolnienia IGF-1 z wątroby. IGF-1 należy do super rodziny znanej jako “czynniki wzrostu” razem z naskórkową transformacją: płytka krwi pochodna tkanki fibroblastycznej, nerwy, i zanik neurogenny czynnika wzrostu. Żaden z czynników wzrostu nie ma związku z szkieletem zewnętrznym tkanki.
Wspólna możliwością tych czynników jest stymulowanie podziału komórek, znanej jako mutogeneza i zróżnicowanie komórek. Znaczy się w przypadku, gdy IGF-1, który oddziałowywuje na tkankę mięśniową będzie inicjował wzrost nowych włókien mięśniowych następnie nowych receptorów dla testosteronu. Użytkownicy jednogłośnie doszli do wniosku, iż poprawia/uwydatnia znacznie cykle sterydowe. Jak i również stanowczo uznano, że ma on możliwość redukcji tkanki tłuszczowej oraz uwydatnieniu waskularyzacji w dużym stopniu.
Jak używać IGF-1
Zakładając, że środek nabyty jest, legit IGF-1 (R3) długi łańcuch tj. IGF-1 wraz z dodanym wiązaniem białkowym. Dawkowanie powinno oscylować miedzy 50mcg – 120 mcg, ed. podzielonych w 2-ch dawkach. Jeden shoot powinien być robiony z w godzinach porannych natomiast drugi przed snem, lub też zaraz po treningu.
Nigdy nie przekraczaj dawki 120 mcg/ed. IGF-1 może spowodować problemy żołądkowo – jelitowe tj. nowotwory jelitowe, obrzęki, opuchlizny, biegunkę oraz wymioty. Większość IGF-1 skoncentrowany jest w 1mg/1000mcg wiec nie ma problemu przy nabieraniu. 10 IU tj. w strzykawce 100 mcg dla porównania. Dla przykładu pierwszy “shoot” robimy z rana w lewy biceps kolejny “shoot” wieczorem w prawy biceps, domięśniowo.
IGF-1 skutki uboczne
Wszystko ma swoje złe strony IGF-1 to nie wyjątek. Używany w dawkach/ilości ok. 100mcg i więcej spowoduje bóle głowy, sporadycznie mdłości oraz przyczynić się do niskiej ilości cukru we krwi lub hipoglikemia w niektórych przypadkach.
IGF-1 od podszewki łączy się z jelitem i powoduje zanik/uszkodzenie tego jelita. Wszystkiego, czego dotknie IGF-1 powoduje jego wzrost oraz powstawanie wielu receptorów na wewnętrznej części ściany. To może spowodować ze hormon wzrostu wszedł w reakcję.
Możesz łatwo tego uniknąć poprzez zmniejszenie dawek oraz długości cyklu. Cykle na IGF-1 powinny oscylować miedzy 4-6 tygodni, po czym powinien nastąpić OFF na kolejne 4-6 tygodni, po czym znów ponawiamy cykl. IGF-1 jest w znacznym stopniu silniejszy od HGH, musisz mieć to na uwadze, podczas gdy dawkowanie, co raz to zwiększasz. Wszyscy wiemy ze zbyt duże dawki HGH mogą spowodować długotrwałe zmiany w naszym organizmie.
Proponowałbym dawki rzędu 50 mcg ed przez 4 tygodnie w tym czasie powinieneś już zauważyć działanie środka. Nie wiem czy potrzebne będą Ci większe dawki, ale myślę ze w przypadku IGF-1 nie będzie to miało znaczenia. W przypadku, gdy 70 mcg Cię nie ruszy zwiększ dawkę do 90 mcg. Po czym na pewno odczujesz znaczną różnicę w innym przypadku masz pewność ze towar, jaki posiadasz jest fake.
Dawki powyżej 120 mcg ed mogą spowodować znaczące problemy, tak jak jego siostra insulina. Przekraczania dawki 120 mcg może spowodować hipoglikemie. Odczujecie bardzo pozytywne skutki przy dawkach rzędu 100 mcg przekraczanie ich zwiąże się jedynie z większymi skutkami ubocznymi oraz marnowanie towaru.
Badania laboratoryjne na temat IGF-1
IGF1 to peptyd podobnej strukturze jak insulina składa się z 70 aminokwasów. Cząsteczka molekularna w przybliżeniu 50% szeregu homologicznego z proinsuliną ma wiele z biologicznej aktywności podobnej do insuliny. IGF-1 to pośrednik w wydłużonym wzroście u człowieka lub inaczej, jaki wzrost możesz osiągnąć. Osocze IGF-1 koncentruje przemienność w wieku, sposobie odżywania się, typie budowy oraz wydzielanie się czynnika wzrostu.
W dodatku IGF1 ma wpływ na naszą pamięć jak i zdolność do uczenia się, zapamiętywania. IGF jest równie ważny przy produkcji tkanki łącznej oraz “ubezpieczaniu” właściwej gęstości kości. Chociaż IGF1 jest bardzo przydatny przy budowaniu tkanki mięśniowej oraz spaleniu tkanki tłuszczowej, Lr3 IGF1 ta wersja jest 2-3x mocniejsza.
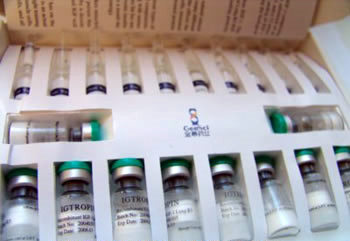
Jak wygląda IGF-1
IGF-1 znajduje się w małych ilościach/opakowaniach. Zawartość waha się między 20 do kilkuset mcg, lecz 100 mcg flakoniki są najbardziej popularne. Substancja przechowywana na słońcu i w gorącej temperaturze traci na wartości, musi być przechowywana w cieniu, kontenerze w odpowiedniej temperaturze w innym przypadku środek jest bezużyteczny.
IGF-1 może być przechowywany w temperaturze pokojowej przez 30 dni.
IGF-1 może być przechowywany w chłodziarce przez rok.
IGF-1 może być przechowywany z zamrażarce przez 2 lata.
Najlepsza opcja jest przechowywanie go w zamrażarce, praktycznie powinien być jedynie wyciągany na czas “shootu”. Po czym natychmiast odstawiony z powrotem.
BADANIA NA TEMAT IGF-1 I WPŁYWU NA OGRANIZM
IGF-1 – nowy czynnik ryzyka miażdżycy naczyń wieńcowych?
Etiologia miażdżycy naczyń i występujących w jej przebiegu ostrych zespołów wieńcowych badana jest od wielu lat. Wiele badań eksperymentalnych i klinicznych dowiodło istotności hipotezy o roli długoterminowego procesu obronnego wobec czynników uszkadzających ścianę naczynia w indukowaniu zmian chorobowych.
Dodatkowo powstawanie lokalnego stanu zapalnego może mieć różne przyczyny, rozpoczynając od zaburzeń gospodarki lipidowej, poprzez bezpośrednie mechaniczne uszkodzenie śródbłonka, po infekcje bakteryjne i wirusowe, co utrudnia proces leczenia, ograniczając go niejednokrotnie do działań objawowych.
Płytka miażdżycowa
W wyniku pobudzenia komórek śródbłonka dochodzi m.in. do wzbudzenia cyklu drugiego przekaźnika (cykliczny monofosforan adenozyny) (CAMP), co inicjuje syntezę czynnika chemotaktycznego monocytów (MCP-1), czynnika stymulującego kolonie makrofagów (MCSF) [1, 2] i molekuł adhezyjnych. Śródbłonek staje się przepuszczalny zarówno dla zoksydowanego i wolnego LDL (lipoproteiny o małej gęstości), jak i dla przyciąganych leukocytów, co wzmaga stres oksydacyjny.
Leukocyty w ścianie naczynia (makrofagi) pochłaniają zmodyfikowane LDL-e, przekształcają się w komórki piankowate oraz uwalniają wiele prozapalnych cytokin, czynników chemotaktycznych i hormonów wzrostu, które między innymi stymulują proliferację i migrację komórek mięśni gładkich, aktywizując w ten sposób głębiej leżące warstwy naczynia.
Wspomniany etap aktywacji komórek mięśniowych w naczyniu wieńcowym jest słabo poznany, a niebagatelną rolę w tym procesie odgrywa insulinowy czynnik wzrostu 1 (IGF-1) [3]. Ogromna różnorodność mechanizmów zachodzących w śródbłonku i głębszych warstwach naczynia, a także nowe odkrycia, wymagają ciągłego modyfikowania dotychczasowego stanu wiedzy. Celem niniejszej pracy jest podsumowanie danych dotyczących roli i funkcji kaskady
insulinowego czynnika wzrostu w patofizjologii miażdżycy naczyń wieńcowych.
IGF-1
Insulinowy czynnik wzrostu 1 jest produktem genu IGF-1, który znajduje się na chromosomie 12. Składa się z 6 egzonów. Występują dwa miejsca startu transkrypcji zlokalizowane na egzonie 1 i 2, co w efekcie może owocować dwoma różnymi karboksyl-końcowymi domenami IGF (Ea i Eb). Transkrypty Eb są głównie syntetyzowane w wątrobie [4].
IGF swój efekt fizjologiczny wywiera poprzez łączenie ze specyficznym receptorem, co jest dodatkowo modulowane poprzez osoczowe białka wiążące IGF-1 (IGFBP). IGF wątrobowy ma większe powinowactwo do białek wiążących i jest wydzielany endokrynnie, w przeciwieństwie do tkankowego IGF wydzielanego przez komórki w sposób auto- lub parakrynowy [5].
IGF-1 jest wydzielany także przez nerki, komórki śródbłonka, naczyniowe komórki mięśni gładkich, chondroblasty, osteoblasty, komórki ośrodkowego układu nerwowego, tkankę tłuszczową oraz przez kardiomiocyty w odpowiedzi na pobudzający jego syntezę hormon wzrostu (GH), który z kolei jest zwrotnie hamowany przez IGF-1 [6, 7].
Dodatkowo wydzielanie IGF (w naczyniowych komórkach mięśni gładkich, VSMC) jest zależne od lokalnie występujących cytokin, takich jak: czynnik nekrotyzujący guzy a (TNF-a) – hamowanie syntezy, płytkowy czynnik wzrostu (PDGF) – stymulacja i hamowanie, angiotensyna II – stymulacja i hamowanie, ox-LDL – hamowanie, LDL – pobudzanie. W komórkach śródbłonka jest hamowany przez hipoksję, transformujący czynnik wzrostu β (TGF-β) czy naczyniowy śródbłonkowy czynnik wzrostu (VEGF) [5]. Synteza IGF-1 maleje wraz z wiekiem [8].
Białka wiążące IGF-1 (IGFBP) stanowią osoczowy rezerwuar IGF, modulując nie tylko jego dostępność, ale i funkcję (wszystkie hamują wydzielanie IGF, a białko 1-3 i 5 może również stymulować jego wydzielanie). Jest to rodzina 6 białek, których ekspresja jest tkankowo specyficzna, a kompartmentowa koncentracja różna [5].
Białka wiążące IGF-1 podlegają polimeryzacji, fosforyzacji, proteolizie i albo występują w przestrzeni zewnątrzkomórkowej, albo są związane z cytoplazmą (Rycina 1.). Przemiany te mają ogromne znaczenie dla funkcji samego IGF-1, ponieważ o ile fosforylacja IGFBP wywołuje większą zdolność wiązania ligandu, hamując jego biologiczną funkcję, o tyle pozostałe przemiany zmniejszają tę zdolność, zwiększając biodostępność IGF-1 dla swoistego receptora.
Wydzielanie
IGFBP przez VSMC zależy od następujących cytokin: TNF-α (pobudza wydzielanie BP 2 i BP 6, hamuje BP 4), ox-LDL (stymulacja syntezy BP 2 i 4), LDL (stymulacja syntezy BP 2 i 4), PDGF (stymulacja syntezy BP 4), angiotensyny II (stymulacja syntezy BP 4). Większość, bo aż 90%, osoczowego IGF-1 transportuje IGFBP-3, który jest związany dodatkowo z białkiem ALS (białko kwasolabilne) [9], tworząc kompleks ternarny (tranzytowa i zapasowa pula IGF). Tkankowo występuje kompleks binarny (bez białka ALS), stanowiący pulę IGF-1 wydzielaną auto- lub parakrynowo.
Uwolnienie IGF-1 z kompleksu następuje po uprzedniej proteolizie IGFBP, przy udziale specyficznych proteaz. Do nich należy odkryta w osoczu ciężarnych PAPP-A (pregnancy-associated plasma protein), mająca ogromne znaczenie w kompensowaniu martwiczych zmian niedokrwiennych, a wydzielana w ostrych zespołach wieńcowych [10]. Tak uwolniony IGF jest dostępny dla receptora tkankowego (Rycina 1.).
Receptor dla IGF-1 jest pojedynczą kopią genu znajdującego się na chromosomie 15. Jest glikoproteiną złożoną z dwóch zewnętrznych podjednostek L o masie 135 kDA, kotwiczących IGF-1 i dwóch wewnątrzkomórkowych podjednostek B, wykazujących aktywność kinazy tyrozynowej, której autofosforylacja jest zjawiskiem inicjującym aktywację dalszych przekaźników wewnątrzkomórkowych.
Poszczególne podjednostki połączone są mostkami dwusiarczkowymi, co nadaje całej cząsteczce formę tetrameru. Jego budowa jest niemal identyczna z budową receptora insulinowego (Rycina 2.) [11]. Ekspresja tego receptora w VSMC jest pobudzana przez angiotensynę II, włóknik, PDGF, a hamowana przez ox-LDL i LDL [5].
Rola IGF
IGF-1 zapobiega upośledzeniu funkcji śródbłonka poprzez działanie przeciwzapalne, wazodylatację, wychwyt glukozy i jej metabolizm, hamowanie glukoneogenezy, hamowanie apoptozy komórek śródbłonkowych, pobudzanie ich migracji i proliferacji, wychwyt wolnych rodników tlenowych i mobilizację komórek progenitorowych [12]. Działania te są determinowane przyłączeniem IGF-1 do swoistego receptora, co aktywuje kinazę tyrozynową.
Ona jest katalizatorem fosforyzacji substratu receptora insulinowego (IRS), cytozolowego białka wielkości 185 kDA, pobudzającego z kolei kinazę 3-fosfatydyloinozytolu, która warunkuje kaskadę kinazy serynowo-treoninowej, początkując w efekcie syntezę NO przez syntetazę NO (NOS) lub warunkując kaskadę MAPK (fosfokinazę aktywowaną przez mitogen).
Wazodylatacja zależna od wielkości naczynia wieńcowego może być warunkowana dodatkowo otwarciem kanałów potasowych [13]. IGF-1 wpływa także na gospodarkę lipidową ustroju, redukując poziomy trójglicerydów i wolnych kwasów tłuszczowych w osoczu [12].
Podsumowując, metaboliczny efekt IGF-1 polega na zwiększaniu insulinowrażliwości komórek ustroju (Rycina 2.). Rola IGF-1 w procesie miażdżycy naczyń wieńcowych nie jest jednoznaczna. Zakładano, że insulinowy czynnik wzrostu może się przyczyniać do powstawania płytki miażdżycowej, bo jest syntetyzowany przez pobudzone VSMC, wzmagając ich proliferację i migrację, ale także przez makrofagi, których koncentrację nasila (na makrofagach dochodzi do ekspresji receptora dla IGF-1). Makrofagi pod wpływem IGF-1 mają zwiększoną zdolność do pochłaniania LDL, a także zdolność do syntezy dalszych cytokin i czynników chemotaktycznych.
Stąd początkowo wysokie poziomy IGF-1 oraz jego receptora wiązano z niestabilną płytką wieńcową [14] i dlatego wzrost IGF-1 miał utrzymywać się do kilku godzin po wytworzonym zawale mięśnia sercowego. Mimo że Grant i wsp. [15] stwierdzili zwiększoną ekspresję IGF-1 i IGFBP2-5 oraz PAPP [9] w niestabilnej płytce miażdżycowej, nowe dane zaprzeczają tym poglądom. Sugeruje się, że destabilizacja płytki miażdżycowej jest związana z ograniczeniem kardioprotekcyjnego wpływu IGF-1.
To efekt niskich poziomów tego białka wywołany hamującym działaniem IGFBP-3 i TNF-α (intensywnie wydzielanym przez pobudzone VCMC) oraz obniżonej ekspresji receptora dla IGF-1. Na podstawie wyników badań na modelu zwierzęcym można stwierdzić, że przyczyną tego zjawiska jest m.in. ox-LDL (hamujący syntezę IGF-1 i doprowadzający do apoptozy VSMC), a przeciwdziałać mu można, dostarczając PDGF lub IGF-1.
Dlatego w płytce hiperechogennej i izoechogennej (płytce stabilnej) stężenia IGF-1 i warunkujących jego dostępność proteaz, np. PAPP, są większe (bo nie ma hamującego wpływu cytokin pozapalnych), a dodatkowo wzrastają w przypadku ostrego niedokrwienia (korelując z troponiną I) [12], aktywując w ten sposób komórki progenitorowe i hamując apoptozę kardiomiocytów, zapobiegając dylatacji i hipertrofii mięśnia sercowego. Jest to system PAAP IGF-1, wczesnej odpowiedzi na niedokrwienie [12].
Hipoteza kardioprotekcyjnego wpływu IGF-1 dodatkowo jest przekonująca, bowiem w świeżej płytce w komórkach śródbłonka stwierdzono zmniejszoną ekspresję IGF-1 i jego receptora, w przeciwieństwie do komórek warstwy mięśniowej, gdzie ekspresja ta była zachowana lub nieznacznie wzmożona i – mimo bezpośredniego dostarczania do VSMC prozapalnego białka BAX i ox-LDL – nie dochodziło do apoptozy wspomnianych komórek [16, 17].
W późnej płytce miażdżycowej, w warstwie śródbłonkowej, szczególnie w miejscach nacieczenia makrofagami i oxLDL poziom IGF-1 i receptora jest prawie nieoznaczalny, w przeciwieństwie do warstwy mięśniowej, gdzie dochodzi do ich nadekspresji [16, 17].
W stabilnych płytkach poziom ekspresji IGF-1 w śródbłonku jest zachowany. Do destabilizacji płytki przyczynia się przebudowa błony podstawnej naczynia, związana z nieprawidłową produkcją jej składników przez VSMC pod wpływem wysokich stężeń m.in. hormonu wzrostu [16, 28]. Do takiej sytuacji dochodzi w cukrzycy insulinozależnej.
W tym przypadku niskie poziomy osoczowego IGF-1 (które są bezpośrednim czynnikiem ryzyka indukcji cukrzycy insulinozależnej) pobudzają sekrecję GH, a ten wpływa na syntezę tkankową IGF-1 [17, 18]. Niezależnie od słuszności którejkolwiek z tych hipotez stwierdzono, że rozległość zawału mięśnia sercowego koreluje z podwyższonymi stężeniami IGF-1 oraz z nasilającym jego wydzielanie GH.
Wnioski te potwierdzają dodatkowo badania na dużych grupach klinicznych [19], szczególnie wśród pacjentów, u których nastąpił zgon w okresie kilku miesięcy od zawału. Badania eksperymentalne na zwierzęcym modelu zawału u transgenicznych myszy z niefizjologicznym zwiększeniem syntezy IGF-1 wykazały znacznie mniejszą liczbę hipertrofii, rozstrzeni komór i nieprawidłowej funkcji komór mięśnia sercowego, natomiast Juul uznał niskie poziomy IGF-1 i wysokie IGFBP3 za bezpośredni czynnik ryzyka wieńcowego [5].
IGF-1 a cukrzyca
W latach 70. uważano, że za cukrzycę może odpowiadać zwiększone wydzielanie hormonu wzrostu. Hipersekrecja GH, powodowana pierwotnie zmniejszonym wydzielaniem IGF-1 przez wątrobę (pula osoczowa), wyzwala tkankowe wydzielanie IGF-1 [12]. Teoria ta również zakładała powstawanie mikroangiopatii, związanej z glikolzylacją w przebiegu cukrzycy końcowych produktów białkowych, która wpływała na skład błon podstawnych, o czym wspominano w poprzednim akapicie.
IGF-1 odpowiada za wychwyt aminokwasów obojętnych, glukozy i syntezę DNA w śródbłonku drobnych naczyń (w przeciwieństwie do śródbłonka dużych naczyń) [5, 20], co – być może w powiązaniu z produktami glikozylacji białek – odgrywa znaczącą rolę w etiopatogenezie mikroangiopatii cukrzycowej. IGF-1, oddziałując zarówno ze swoim receptorem, jak i z insulinowym, zwiększa insulinowrażliwość i pobudza kinazę fosfatydyloinzytolu, działając antagonistycznie do GH.
Dodatkowo hiperinsulinizm może nasilać ekspresję mRNA IGF-1 [5]. U myszy transgenicznych posiadających mutacje w genie IGF-1 wątrobowego dochodziło do insulinooporności, stąd wniosek, że obniżone stężenie IGF-1 może być czynnikiem ryzyka cukrzycy.
Restenoza
Za proces restenozy odpowiada przerost i pogrubienie neointimy związany z proliferacją komórek mięśni gładkich naczynia [5]. Zjawisko to jest z kolei uwarunkowane wzmożoną syntezą cytokin prozapalnych, chemokinin oraz IGF-1 i jego receptora, którą wielokrotnie obserwowano po zabiegach stentowania naczyń wieńcowych związanych z uszkodzeniem śródbłonka, co było bezpośrednim sygnałem inicjującym wspomniane zmiany [3, 21, 22].
Powyższe spostrzeżenia potwierdzono w badaniach na myszach transgenicznych z nad- ekspresją IGF-1, które wykazywały znaczną hiperplazję mięśni gładkich naczynia w przeciwieństwie do zwierząt posiadających dodatkową kopię genu IGFBP-4, wykazujących hipoplazję warstwy mięśniowej [3, 23, 24]. Kilka miesięcy po zabiegu balonikowania lub stentowania naczyń wieńcowych poziom ekspresji m-RNA IGF-1 powraca do normy.
Może to być kolejnym dowodem na ochronny wpływ IGF-1 na mięsień sercowy, mimo że paradoksalnie reakcja przynosi odwrotny efekt. Potwierdzeniem tej hipotezy jest dodatkowo fakt, że rola IGF-1 w regulacji homeostazy ściany naczynia nie ogranicza się tylko do mitogennego oddziaływania na komórki mięśni gładkich, ale jest również związana z kontrolą syntezy tropoelastyny przez te komórki, czym się tłumaczy wzrost elastyczności ściany w odpowiedzi na jej uszkodzenie [3, 25].
IGF-1, wzmagając syntezę tropoelastyny, jest czynnikiem transkrypcyjnym (za regulację posttranskrypcyjną odpowiada TGF-a). Pozytywne próby z zastosowaniem angiopeptyny hamującej niekorzystną odpowiedź ściany naczynia na działanie IGF-1 w modelu zwierzęcym [5, 26] zaowocowały podjęciem prób klinicznych, lecz jak dotąd nie potwierdziły jej skuteczności [5, 27].
Reasumując, IGF-1 bierze udział w homeostazie naczyniowej. Jego rola w tym procesie budzi wiele kontrowersji i sprzecznych hipotez. Może bowiem przyczyniać się do migracji i proliferacji komórek mięśni gładkich, ale z drugiej strony umożliwia makrofagom wychwyt LDL, zapobiega agregacji płytek.
W miarę postępu procesu zapalnego efekt IGF-1 jest coraz słabszy, ponieważ poszczególne cytokiny zapalne hamują jego ekspresję (podobnie jak i jego receptora, zwiększając jednocześnie syntezę białek wiążących), który to efekt dodatkowo potęguje uszkadzający śródbłonek ox-LDL. W wypadku zaawansowanych zmian miażdżycowych, wysokie stężenie IGF-1, jego receptora i niskie białek wiążących chroni płytkę przed destabilizacją. W ostrych zespołach wieńcowych stężenie IGF-1 wzrasta, co zapobiega niekorzystnej przebudowie mięśnia sercowego w mechanizmie aktywacji progenitorowych komórek sercowych, a także inhibicji apoptozy istniejących.
Opublikowane kilka miesięcy temu badanie Rotterdam Study sugeruje związek niskich poziomów IGF-1 z ryzykiem wystąpienia miażdżycy, zmian udarowych i innych chorób neurologicznych [28]. Nowatorski charakter tych badań polegał na odnalezieniu wpływu polimorfizmów w rejonie promotorowym genu IGF-1 na poziom tego białka, co jest także przedmiotem naszych badań, ale w grupie pacjentów poddawanych planowym procedurom angiograficznym.
Za kardioprotekcyjnym charakterem IGF-1 przemawia dodatkowo to, że jego molekularny efekt jest wywoływany przez syntetazę NO. Ze względu na swój efekt mitogenny odgrywa znaczącą rolę w powstawaniu zjawiska restenozy. Prowadzone są intensywne badania nad rolą, jaką odgrywa IGF-1 w procesie cukrzycy, skojarzone z próbą jego suplementacji. Szerokie spektrum oddziaływań molekularnych IGF-1 wymaga dalszego poszukiwania mechanizmów, które, być może, okażą się kluczowe dla wyjaśnienia etiologii wielu chorób cywilizacyjnych.
Autor: 50 Dollars (sfd)
Komentarze do artykułu możesz zobaczyć na forum klikając TUTAJ
Jeśli zainteresował Cię ten artykuł i chcesz wiedzieć więcej kliknij TUTAJ