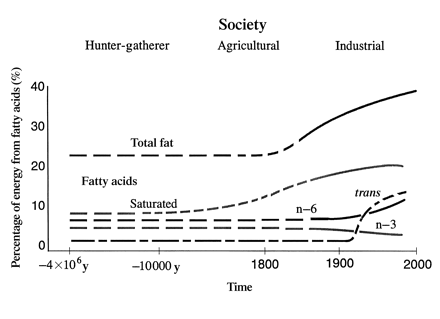
Prozdrowotne właściwości kwasów n-3 wykazano głównie w profilaktyce i leczeniu chorób serca, nadciśnienia, cukrzycy typu 2, chorobach nerek, reumatycznym zapaleniu stawów, wrzodziejącym zapaleniu jelita grubego, chorobie Leśniowskiego-Crohn’a i przewlekłej zaporowej chorobie płuc. Zmiany nawyków żywnościowych spowodowały zmianę stosunku kwasów o6;o3 z 1-2;1 do >30;1 przyczyniając się do rozwoju wielu chorób. Rozwój technologiczny i agrokulturalny spowodował zmianę w proporcji i ilości tłuszczów w diecie [1]. Poniżej, hipotetyczna zmiana zawartości i rodzaju tłuszczów w diecie na przestrzeni lat:
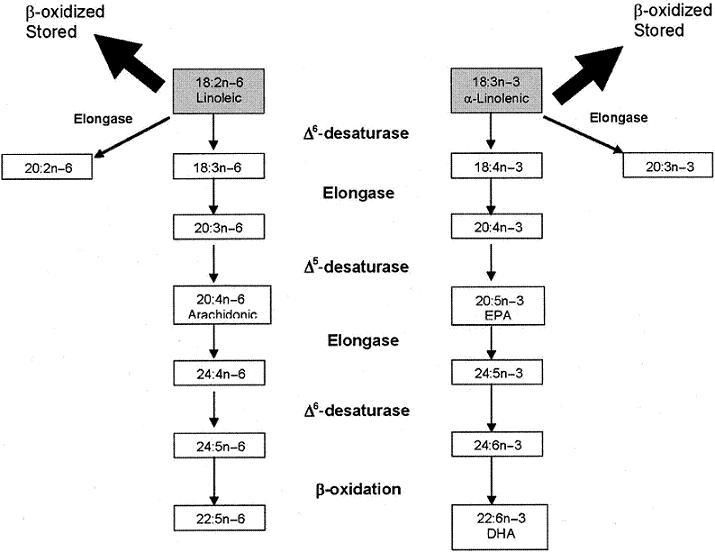
Metabolizm kwasów PUFAs (Polyunsaturated fatty acids) n-3, n-6 jest ze sobą zintegrowany. Prekursorem do wytwarzania długołańcuchowych pochodnych kwasów PUFAs jest kwas linolowy (Linoleic acid (LA; 18:2n-6)) oraz kwas Alfa-linolenowy (Alfa-Linolenic acid (ALA; 18:3n-3)). Desaturacja i elongacja wymaga pracy tych samych enzymów wg. schematu poniżej[2]:
Efekt biologiczny tych kwasów różni się poprzez produkcję różnego rodzaju hormonów tkankowych, o różnym, często przeciwnych wpływie na organizm człowieka. W referencji znajduje się dokładny opis powyższego schematu [1,2]. Dysproporcje kwasów PUFAs w dzisiejszej diecie powodują, iż wpływają one na organizm prozakrzepowo, prozapalnie oraz kancerogennie [1,3].
Z powyższych powodów dużo ważniejsze są kwasy n-3. Na szczęście, biodostępność ALA wynosi 96%, część zaś tracona jest w procesie beta oksydacji. Ilość ta waha się w granicach 15-33%, średnio wynosi 22% u kobiet i 33% u mężczyzn, prawdopodobnie z powodu różnicy w ilości tkanki mięśniowej. Tak więc również wykorzystanie kwasu ALA do tworzenia dalszych pochodnych PUFAs (kwas eikozapentaenowy (EPA; 20:5n-3) i dokozaheksaenowy (DHA; 22:6n-3)) oraz stężenie ich w organizmie będzie większe u kobiet z powodu różnicy w pracy hormonów (estrogen, testosteron). Autorzy badań twierdzą, iż powodem tego są większe zapotrzebowania kobiet na te kwasy w czasie ciąży. Faktem wartym uwagi jest, iż ilość DHA w mleku matki nie zmienia się przy zmianie ilości dostarczanych kwasów PUFAs w diecie, co sugeruje, iż jego stężenie w mleku odpowiada ich rezerwom organizmu matki, tzn. wpływ tu ma odpowiednia dieta przed jak i w trakcie trwania ciąży[4].
ALA jest niemalże w dwukrotnie wyższych ilościach zużywany w Beta-oksydacji niż kwas palmitynowy, stearynowy i oleinowy, co prawdopodobnie spowodowane jest większym powinowactwem tego związku do palmitylo-transferazy-1 karnityny[4]. Natomiast w dietach w których poza tłuszczem bogatym w kwasy n-3 znajdują się również inne ich rodzaje, widoczna jest różnica w stężeniach kwasów PUFAs w krwi po spożyciu tej samej dawki kwasu ALA [6], bez zmiany ilości wykorzystania go w spalaniu komórkowym[4]. Fakt ten świadczy o większym powinowactwie tego kwasu do desaturacji i elongacji w towarzystwie innych tłuszczy, co może być argumentem za tezą, by produkty z tłuszczowymi kwasami morskimi spożywać wraz z tłuszczami nasyconymi. Zostało to potwierdzone w jednym z badań, iż kwasy nasycone zwiększają ekspresję genów desaturazy delta 5 i delta 6 w jednojądrzastych komórkach krwi obwodowej [4]. Innym składnikiem również wpływającym na ilość kwasów PUFAs we krwi są flawonoidy – antocyjany. Zwiększają one ich stężenie prawdopodobnie poprzez podniesienie aktywności desaturazy delta-6, która wykazuje większe powinowactwo do kwasu ALA niż LA, nie powodując więc jednoznacznego wzrostu pochodnych LA we krwi [6].
Według badań ilość wytworzonego kwasu EPA z ALA jest dość niska, DPA jeszcze niższa a poziom wytwarzanego DHA w dużo znacznym stopniu jeszcze mniejsza. Przeprowadzono badania na temat wpływu dostarczanego kwasu DHA / EPA + DHA na działanie zwrotne mechanizmu ich syntezy. Zauważana jest znaczna redukcja ilości kwasu ALA wykorzystywanego do syntezy dalszych kwasów przy zwiększeniu ilości kwasów PUFAs w diecie. Wynika z tego, iż zwiększenie ich ilości w diecie przyczynia się do redukcji ich syntezy w organizmie, jednak nie wiadomo dokładnie czemu tak się dzieje. Sugestią jest obecność receptora PRARalfa w miejscu aktywnym desaturazy delta-6, za pomocą tego receptora kwas DHA przyłącza się do tego enzymu hamując jego aktywność [4]. A więc, czy nie lepszym rozwiązaniem jest suplementacja ALA/EPA czy ALA+EPA niż DHA w jakiejkolwiek formie?
Nie są to zdecydowanie korzystne informacje ze względu na obfitość kwasów n-6 w żywności oraz konieczną ilość kwasów n-3 do zrównoważenia niekorzystnej proporcji. Tym bardziej, niema logicznego wytłumaczenia większego powinowactwa kwasu ALA do palmitylo-transferazy-1 karnityny w porównaniu z innymi kwasami.
Burdge GC oraz Calder PC w swojej pracy [4], odnoszą się do badań w których badano zmiany stężeń kwasów PUFAs w krwi/tkankach po podaniu doustnym kwasu ALA. Korelacja ta była korzystna i dowodzi tego, iż w przypadku braku możliwości dostarczenia odpowiedniej ilości kwasów n-3 z diety powinno się sięgnąć po ich odpowiedniki w suplementacji. Korzystną korelację między spożyciem czy stężeniem kwasów n-3 w organizmie człowieka a chorobami wykazano wobec wielu chorób, m.in. tych wymienionych na początku niniejszej pracy [1].
Zaleceniem wielu naukowców, dietetyków jest spożywanie mięsa z zwierząt hodowanych ekologicznie, ryb łowionych z naturalnych środowisk, jaj z chowu ekologicznego, roślinności uprawianej metodami naturalnymi bądź żywności wzbogacanej kwasami n-3. W przypadku braku możliwości dostarczenia odpowiedniej ilości kwasów n-3 organizmowi, warto sięgnąć po suplementację.
1. Artemis P Simopoluos. Essentrial fatty acids in healt and chronic disease. Am J Clin Nutr September 1999 vol. 70 no. 3 560S-569S
2. Ana Baylin, Edward Ruiz-Narvaez, Peter Kraft and Hannia Campos. α-Linolenic acid, Δ6-desaturase gene polymorphism, and the risk of nonfatal myocardial infarction. Am J Clin Nutr February 2007 vol. 85 no. 2 554-560.
3. Małgorzata Jelińska. Kwasy tłuszczowe – czynniki modyfikujące procesy nowotworowe. Biuletyn Wydziału Farmaceutycznego Akademii Medycznej w Warszawie. 2005, 1,1-9.
4. Burdge GC, Calder PC. Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults. Reprod. Nutr. Dev. 45 (2005) 581-597.
5. Saunders DR, Sillery JK. Absorption of triglyceride by human small intestine: doseresponse relationships. Am J Clin Nutr 1988, 48: 988-991.
6. Marie-Claire Toufektsian, Patricia Salen, Francois Laporte, Chiara Tonelli, and Michel de Lorgeril. Dietary Flavonoids Increase Plasma Very Long-Chain (n-3) Fatty Acids in Rats. J. Nutr. January 1, 2011 vol. 141 no. 1 37-41.
Zapraszam do dyskusji na forum klikając TUTAJ
Autor: Skalar. (sfd)